Ouverture d’un site investigateur à Paris pour deux essais cliniques de thérapie génique dans les maladies de Sanfilippo type A et B.
1 – AAVance, essai clinique de phase II/III pour le traitement de la maladie de Sanfilippo type A par administration du vecteur thérapeutique LYS-SAF302
Le laboratoire Lysogène a débuté le recrutement pour son essai clinique avec quatre sites ouverts en début d’année aux USA. Pour l’Europe, le premier site investigateur devrait ouvrir dans les prochaines semaines à Paris (Dr Bénédicte Héron – hôpital Armand Trousseau). Suivront d’autres sites en Angleterre, Allemagne et Pays-Bas.
L’objectif de l’essai est d’évaluer l’efficacité et l’innocuité du vecteur thérapeutique LYS-SAF302 pour le type A de la maladie de Sanfilippo.
Le but attendu est l’amélioration ou la stabilisation des troubles du comportement et du développement cognitif des enfants malades mesurés à l’aide de questionnaires et d’activités constituant ce qu’on appelle des tests neuropsychologiques. L’évaluation du comportement apprécie les aptitudes des enfants en termes de communication, de vie quotidienne, de socialisation, de capacités motrices et de comportement adaptatif. Les évaluations neurocognitives mesurent la capacité d’attention, les aptitudes de langage, l’organisation visuelle, la mémoire et les capacités d’apprentissage des enfants.
L’essai consiste à injecter directement dans le cerveau des enfants malades une quantité importante de vecteur (virus AAVrh10 rendu inoffensif) transportant une copie fonctionnelle du gène de l’enzyme (enzyme SGSH) défaillante dans cette maladie. Le vecteur va pénétrer dans les cellules du cerveau où le gène fonctionnel permettra la production de l’enzyme SGSH.
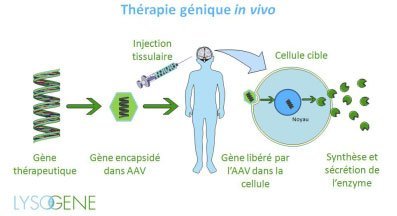
L’essai clinique prévoit de traiter 20 enfants. Les deux critères d’inclusion sont :
>être âgé au minimum de 6 mois,
>avoir un développement neurocognitif correspondant à au moins la moitié de celui des enfants du même âge (Quotient Développement de 50% et plus). Ainsi un enfant malade de 6 ans doit avoir un niveau de développement (comportemental et cognitif) comparable à un enfant non malade d’au moins 3 ans. L’étude de l’Histoire Naturelle pour les enfants atteints de la maladie de Sanfilippo A, donne à présager qu’au-delà de 6 ans, le développement neurocognitif est habituellement en deçà des 50%.
Les formes non neurologiques ou à évolution non classique de la maladie, la participation à d’autres essai de thérapie génique ou cellulaire, ou une contre-indication à un traitement par des immunosuppresseurs font partie des critères d’exclusion prévus pour cet essai.
Le recrutement en France débute en avril – mai 2019; pour tout renseignement complémentaire, vous ou votre médecin pouvez contacter le docteur Bénédicte Héron (Hôpital Armand Trousseau – Service de Neuropédiatrie – 26 avenue du Dr A Netter – 75012 PARIS).
2-Essai clinique de phase I/II pour le traitement de la maladie de Sanfilippo type B par administration intraveineuse d’un vecteur rAAV9.CMV.hNAGLU
Après les Etats-Unis et l’Espagne, le laboratoire Abeona Therapeutics va prochainement ouvrir en France son troisième centre investigateur pour mener son essai dans la maladie de Sanfilippo B.
 L’objectif est d’évaluer la sécurité d’un traitement par le vecteur AAV9 (virus rendu inoffensif) contenant le gène humain nécessaire pour produire l’enzyme NAGLU déficiente dans la maladie de Sanfilippo type B. Lors d’évaluations chez l’animal, ce vecteur administré par voie intraveineuse a permis de retrouver une certaine activité de l’enzyme NAGLU dans le cerveau, une amélioration des fonctions comportementales et une augmentation de la survie. Ces résultats suggèrent qu’une certaine quantité de vecteur injecté par voie intraveineuse pourrait passer à travers la barrière naturelle du cerveau et pénétrer dans les cellules de celui-ci.
L’objectif est d’évaluer la sécurité d’un traitement par le vecteur AAV9 (virus rendu inoffensif) contenant le gène humain nécessaire pour produire l’enzyme NAGLU déficiente dans la maladie de Sanfilippo type B. Lors d’évaluations chez l’animal, ce vecteur administré par voie intraveineuse a permis de retrouver une certaine activité de l’enzyme NAGLU dans le cerveau, une amélioration des fonctions comportementales et une augmentation de la survie. Ces résultats suggèrent qu’une certaine quantité de vecteur injecté par voie intraveineuse pourrait passer à travers la barrière naturelle du cerveau et pénétrer dans les cellules de celui-ci.
L’essai prévoit deux groupes de malades recevant une unique injection intraveineuse. Pour chaque groupe, la quantité de vecteur administré est différente (un groupe à faible dose et un groupe à haute dose). Au total, 9 enfants atteints de maladie de Sanfilippo B pourront participer à cet essai dont le but premier est de déterminer l’innocuité/la toxicité du traitement. Des évaluations secondaires donneront des indications sur un éventuel effet thérapeutique sur des marqueurs biologiques et cliniques (volume foie et rate, tests comportementaux et cognitifs) de la maladie.
Des critères d’inclusion et d’exclusion encadrent les possibilités de participation à l’essai. L’âge minimum est fixé à 6 mois, et comme pour l’essai Lysogène, l’Histoire Naturelle de la maladie présume difficile une inclusion au-delà de 5- 6 ans selon les critères fixés.
Pour tout renseignement complémentaire, vous ou votre médecin pouvez contacter le docteur Bénédicte Héron (Hôpital Armand Trousseau – Service de Neuropédiatrie – 26 avenue du Dr A Netter – 75012 PARIS).
[/Delphine GENEVAZ/]
25 avril 2019























